在脊椎动物胚胎发育过程中,造血干祖细胞(Hematopoietic Stem and Progenitor Cells, HSPCs)起源于主动脉区域中的生血内皮(Hemogenic Endothelium, HE),通过内皮-造血转化(Endothelial-to-Hematopoietic Transition, EHT)过程生成。这一过程的顺利进行依赖于精细调控的炎症信号:适度的炎症有助于HSPC的生成,而过度的炎症则会导致造血缺陷。然而,内皮细胞如何主动抑制过度炎症以维持造血微环境的稳定,尚不明确。
2025年12月5日,刘峰教授团队在美国科学院院刊(PNAS)上发表题为“Ace2 safeguards embryonic hematopoietic stem and progenitor cell production by restraining Nlrp3-mediated pyroptosis”的研究论文,揭示了血管紧张素转换酶2(Ace2)在胚胎造血过程中的关键保护作用。该研究发现,Ace2通过抑制NLRP3–Caspase-1信号通路和细胞焦亡(pyroptosis),维持生血内皮的正常功能和HSPC的产生。

研究人员首先在斑马鱼和小鼠模型中系统分析了ace2的表达与功能。结果显示,ace2在内皮细胞中高表达,尤其在主动脉腹壁区域富集。通过基因敲降和基因敲除实验,发现Ace2缺失会导致HSPC数量显著减少,并伴随生血内皮标志物(如runx1、gata2b等)表达下降,表明其影响HE和HSPC的特化。
机制研究表明,Ace2缺失会引起内皮细胞中NLRP3信号通路的异常激活,进而触发Caspase-1依赖的细胞焦亡。转录组分析和蛋白检测均显示,Ace2缺陷的细胞内NLRP3、cleaved Caspase-1和IL-1β等焦亡相关分子显著上升。通过药物抑制NLRP3(MCC950或UK5099)或Caspase-1(Z-VAD-FMK或Belnacasan),均可有效恢复Ace2缺陷胚胎中的HSPC数量,证实该通路在Ace2调控造血中的重要地位。
作为肾素-血管紧张素系统(RAS)的关键酶,Ace2可将促炎性的Angiotensin II转化为抗炎性的Angiotensin-(1-7)。研究人员发现,外源性补充Ang-(1-7)可显著抑制NLRP3活化,降低炎症因子表达,并成功挽救Ace2缺陷引起的造血缺陷表型。由此说明,Ace2通过其酶活产物Ang-(1-7)发挥抗炎与造血保护作用。
此外,研究团队在小鼠胚胎AGM区进行的体外功能实验证明Ace2敲低显著损害内皮-造血转化过程和CD45⁺造血细胞的生成, 验证了Ace2在哺乳动物造血过程中的保守性。
该研究首次揭示了Ace2在胚胎期造血过程中的关键作用(图1),阐明“ACE2/Ang-(1-7)–NLRP3–焦亡”信号轴通过维持血管内皮微环境稳定,保障HSPC正常发育。该工作不仅有助于深入理解炎症信号对造血过程的调控,也为炎症相关的血液疾病及干细胞再生医学提供了潜在的治疗靶点。
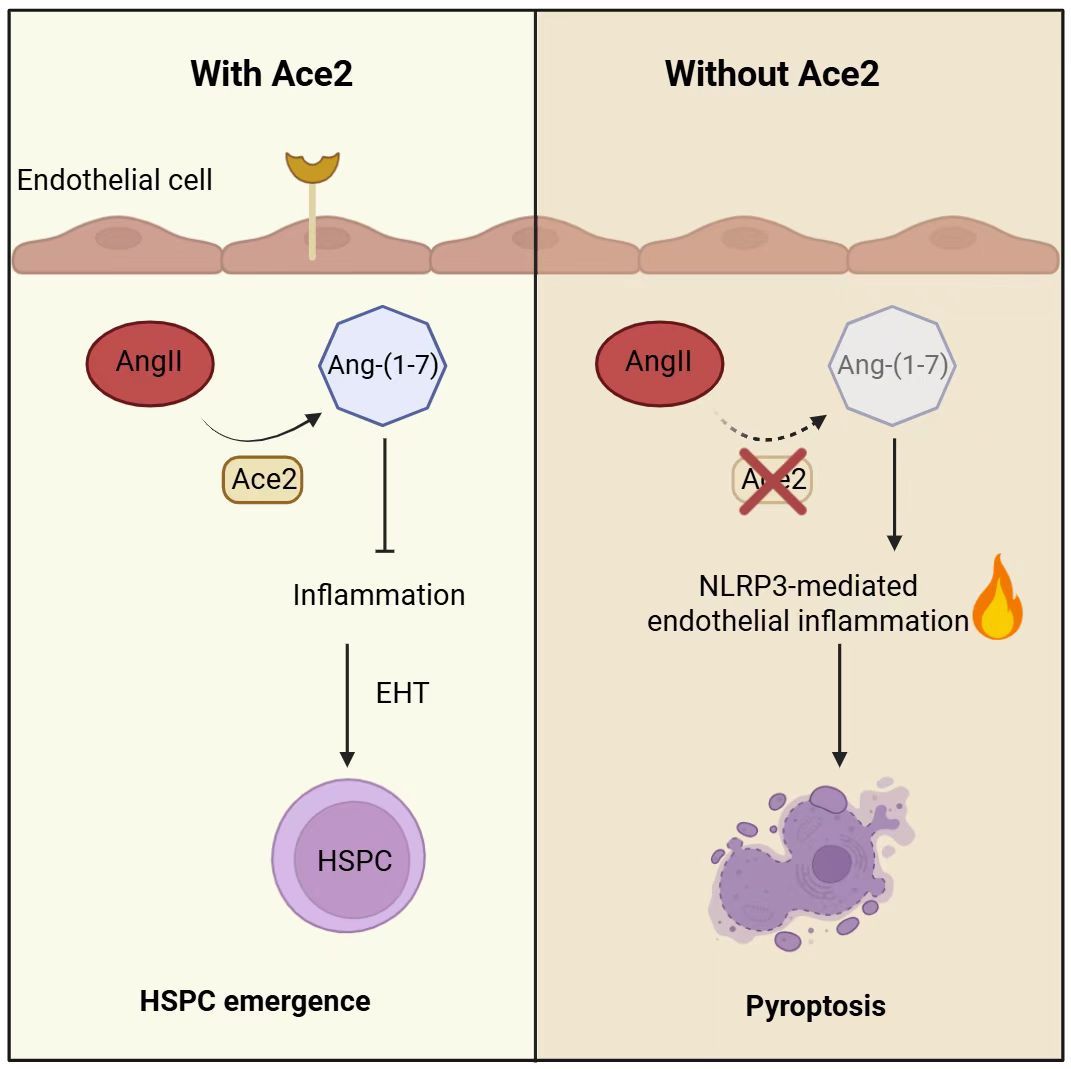
图1. Ace2调控造血干祖细胞产生的模式图
刘峰教授为通讯作者,实验室博士毕业生夏均、山东大学生命科学学院硕士研究生申凌雪、中科院动物所博士研究生刘怡宁为该论文的共同第一作者;中国医学科学院血液病医院(中国医学科学院血液学研究所)王璐研究员也做出重要贡献。感谢南方科技大学温子龙教授和中国科学院神经科学研究所杜久林研究员在实验材料方面的帮助。该研究得到了国家自然科学基金、国家重点研发计划以及中国科学院动物研究所自主部署项目资助。
原文链接:https://doi.org/10.1073/pnas.251564112
