近日,生命科学学院王显伟教授课题组在甲壳类水产动物免疫与病害防控领域取得新进展,成果以“Linking the production of reactive oxygen species to the expression of antimicrobial peptides through aquaporin in an arthropod”为题发表于美国科学院院刊(PNAS)。该研究以甲壳类为模型揭示了动物免疫反应调控新机制,也为水产病害药物开发提供了关键科学依据。王显伟教授为通讯作者,博士生魏哲为第一作者。

胞外活性氧(ROS)产生和胞内免疫基因转录是两种典型的免疫反应。在泛甲壳类中,由双氧化酶2产生的细胞外ROS能直接杀伤病原;由Relish介导转录产生的抗微生物肽(AMPs)可破坏病原结构。但长期以来,这两种免疫反应被认为是彼此独立的平行分支。
王显伟教授课题组利用克氏原螯虾为模型,揭示了两种反应的交叉协同新模式,改变了上述传统认识。研究发现感染诱导产生的大量胞外ROS并非只用于直接杀伤,其中一部分会被定位于细胞膜上的水通道蛋白(Aqp4)转运至细胞内。这些进入细胞的ROS作为信使,促进FoxO转录因子入核,调节Relish表达。最终,增加的Relish分子驱动了众多AMPs的转录合成。
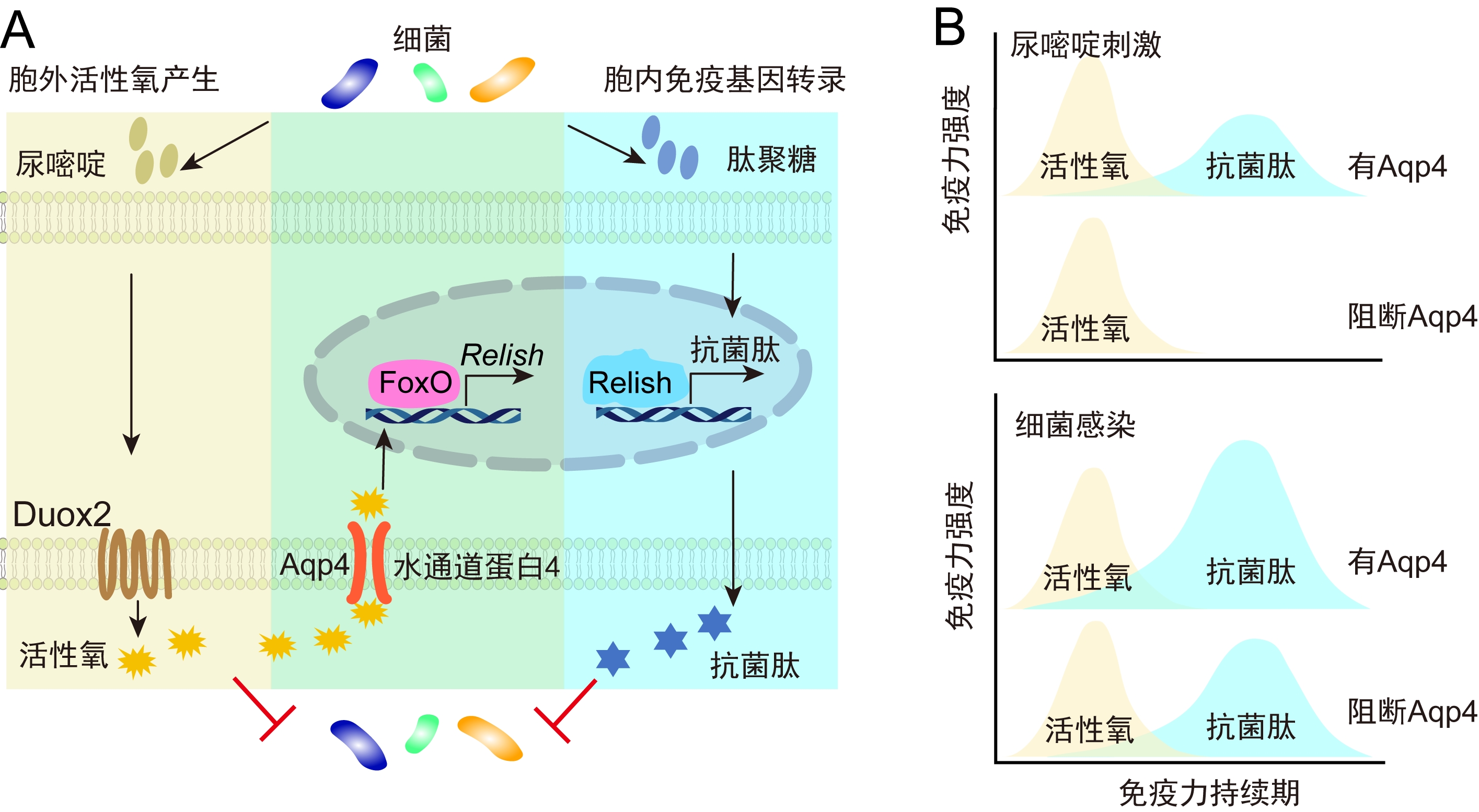
ROS/Aqp4/FoxO/Relish/AMPs信号轴具有关键的生物学意义。通过将ROS效应拓展到AMPs效应,该信号轴增强了免疫反应强度。另外,由于ROS半衰期短,而AMPs可在体内维持较长时间,这一机制也实现了免疫效应从“快而短”到“强而久”的升级。
上述发现揭示了机体统筹不同免疫反应、构筑更高效和更持久免疫防御的新机制,既为理解动物免疫反应调控的复杂性和系统性提供了全新视角,也可指导开发水产养殖病害防控新策略。基于该机制,课题组已发现了尿嘧啶等系列物质在水产养殖病害防治中的应用潜力,多个候选药物已获得发明专利授权,且已实现转化应用。
上述工作得到了国家自然科学基金的支持。
原文链接:https://doi.org/10.1073/pnas.2502570122
