4月24日,山东大学生命科学学院邵明教授联合中国科学院昆明动物研究所毛炳宇研究员和山东大学生命科学学院刘相国教授在Molecular Cell杂志在线发表了题为“Prkra dimer senses double-stranded RNAs to dictate global translation efficiency”的研究论文。该工作使用斑马鱼和小鼠早期胚胎以及小鼠胚胎干细胞作为多潜能干细胞的模型,发现了PRKRA二聚体是干细胞中特异并且跨物种保守的dsRNA感受器,并解析了其通过劫持eIF2复合体引发整体翻译抑制的分子机制。

双链RNA(dsRNA)是一种保守的病原相关分子模式,是病毒复制的标志物。dsRNA由被称为模式识别受体(Pattern Recognition Receptor, PRR)的感受器识别。经典的dsRNA感受器包括内体中的 TLR3和细胞质中的RIG-I和MDA5等。这些dsRNA感受器会触发信号转导,导致干扰素(interferon,IFN)和促炎细胞因子的表达和分泌。而干扰素作为一种自分泌和旁分泌因子,则与细胞表面的受体结合,启动JAK/STAT 信号级联反应,上调一系列抗病毒反应相关的基因表达,这些基因统称为干扰素刺激基因(Interferon Stimulated Gene,ISG),它们可以干扰病毒生活史的几乎所有阶段。
响应IFN信号的蛋白激酶 R(PKR,也称为EIF2AK2)也是一个重要的dsRNA的感受器。它可以被dsRNA激活,磷酸化翻译起始因子eIF2亚基eIF2α的Ser51位点,阻断eIF2三元复合物和43 S翻译前起始复合物的形成,因此导致翻译整体水平的抑制。这个过程被称为整合应激反应(Integrated Stress Response,ISR)。dsRNA诱导的ISR通常被视为一种抗病毒先天免疫机制,直接抑制病毒蛋白合成。然而,由于这些发现和概念主要是在分化细胞中建立的,其在多能干细胞和早期胚胎中的适用性仍不明确。
越来越多的证据表明,未分化细胞和终末分化细胞对病毒和dsRNA刺激的反应存在显著差异。多潜能的胚胎干细胞(ESC)和畸胎瘤细胞在病毒感染或模拟dsRNA的poly(I:C)处理后不会产生I型干扰素(IFNs)。此外,这些细胞对外源性干扰素的反应也很弱,这表明它们并不主要依赖于经典的IFN信号通路进行抗病毒反应。相反,一小部分内源性表达的ISGs保护干细胞免受病毒感染,但PKR并不在这些内源表达的ISG中,这也引发了PKR是否参与早期发育阶段翻译调控的疑问。
斑马鱼胚胎本身是一团干细胞,易于通过显微注射进行 dsRNA刺激,便于基因功能筛选,并且能轻松获取大量材料进行生物化学分析,因此是进行这项研究的理想起始材料。dsRNA在斑马鱼早期胚胎中抑制蛋白质合成,整体翻译活性在长dsRNA(>160 bp)刺激下甚至下降到正常水平的30%。核糖体印记分析(Ribo-seq)排除了dsRNA刺激对翻译起始、延伸和终止过程的影响。实际上这种dsRNA引发的翻译抑制类似于ISR,干扰了翻译的预起始过程,早于核糖体装载到mRNA上。然而,这种类似于ISR的现象并不依赖PKR和磷酸化的eIF2α(p-eIF2α),因为在PKR突变体胚胎中, eIF2α不能被磷酸化,但是翻译抑制依然存在。
排除PKR后,研究人员进行了RNA pulldown结合质谱分析,发现了dsRNA相关的两类关键性蛋白:dsRNA结合蛋白和翻译起始因子eIF2和eIF2B。其中拥有三个串联dsRNA结合域(dsRBD)的Prkra富集度和丰度都名列前茅。遗传证据表明,Prkra缺失的斑马鱼胚胎感受dsRNA刺激的能力显著减弱,dsRNA不能有效诱导翻译抑制,提示Prkra才是干细胞中调控翻译效率的dsRNA感受器。
在验证Prkra结合dsRNA的凝胶迁移实验(EMSA)中,研究人员意外发现Prkra-dsRNA复合物呈现阶梯状条带分布,相邻条带的分子量正好相差约65 kD,相当于Prkra蛋白分子量的两倍,提示Prkra主要是以二聚体的形式特异性结合dsRNA。进一步通过生化分析和AI预测,发现Prkra通过其前两个dsRBD结合dsRNA,而dsRBD3则主要介导二聚化。Prkra的这种结合dsRNA能力和二聚化形式确保了其能在dsRNA上有序排列。
受RNA pulldown和质谱结果的启发,研究者进一步发现Prkra在dsRNA存在的前提下特异性的结合eIF2,这种结合能力高度依赖Prkra蛋白dsRBD3结构域的二聚化。在dsRNA刺激后,Prkra二聚体能够阻止eIF2组装到40S核糖体亚基上,来减少43S翻译起始前复合物(PIC)的形成,并最终实现翻译抑制。
这种独特的翻译调控机制能够高效抑制鲤春病毒(SVCV,一种负链RNA病毒)在斑马鱼胚胎中的复制。Prkra蛋白能够结合SVCV病毒复制过程中生成的dsRNA,其缺失导致SVCV病毒在斑马鱼早期胚胎中爆发性复制。相反,PKR和干扰素系统在斑马鱼早期胚胎中并不能被SVCV和dsRNA激活。
值得注意的是,PRKRA的翻译调控能力是跨物种保守的,它赋予哺乳动物胚胎和胚胎干细胞感知dsRNA的能力。同样重要的是,在分化细胞系Neuro-2a中,PRKRA介导的翻译调控机制也依然得到保留,它与PKR/p-eIF2α轴几乎同等重要,协同实现翻译抑制。
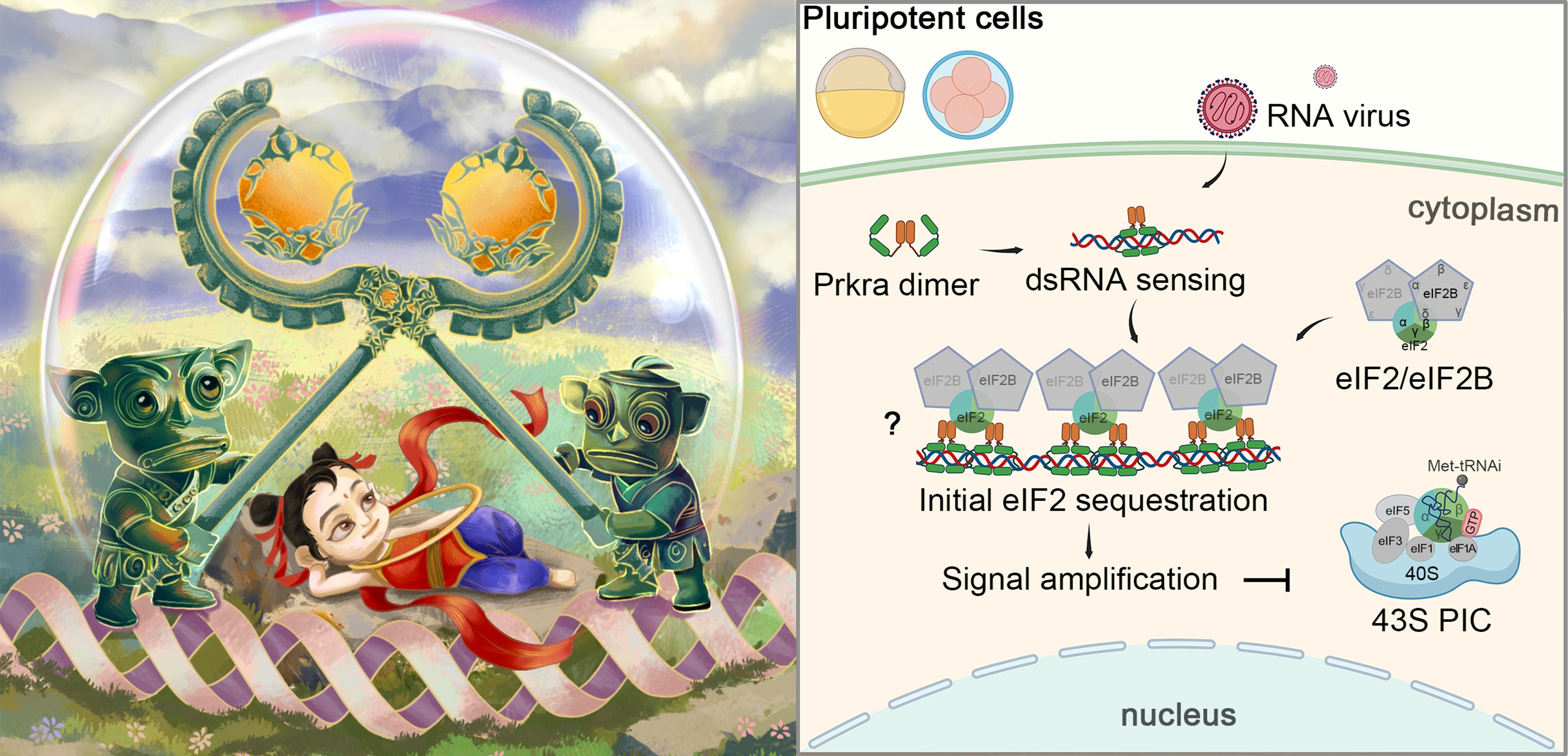
受动画电影《哪吒之魔童降世》的启发,PRKRA 在功能上类似于受人喜爱的结界兽,需要二聚化(配对)才能有效运作。它们站在象征dsRNA 的A型双螺旋的丝带上,而它们交叉的法器则象征PRKRA dsRBD3的二聚化。由此形成的结界限制了代表 eIF2 复合体的哪吒,阻止这种强大的存在在翻译过程中发挥作用。
总体而言,该工作揭示了一种长期被忽略的dsRNA感受机制和平行于ISR的翻译调控机制,并且提示细胞分化过程中“dsRNA感受器转换”现象的普遍存在。它特指在细胞分化过程中广泛存在的dsRNA感受器从不激活干扰素的Prkra到激活或响应干扰素的RIG-I、MDA5、TLR3和PKR等的前后承接。研究这种转换的生物学意义和其与细胞分化标志性事件的偶联关系是未来非常有趣的研究方向,此外Prkra介导的应激反应是否可以用于发展新型的抗病毒和抗肿瘤的方法也值得高度关注。
山东大学生命科学学院邵明教授、中国科学院昆明动物研究所毛炳宇研究员、山东大学生命科学学院刘相国教授为本论文的共同通讯作者。山东大学生命科学学院博士生陆通为本论文的第一作者。该研究得到了国家自然科学基金原创探索类计划项目和面上项目等多项支持。
原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(25)00308-9
