近日,The Plant Cell在线发表了山东大学生命科学学院谭保才教授课题组题为“Maize PPR-E proteins mediate RNA C-to-U editing in mitochondria by recruitingtransdeaminase PCW1”的研究论文,该研究揭示了玉米线粒体PPR-E类蛋白对RNA进行C-U编辑的新机制。山东大学生命科学学院博士后王勇为该论文第一作者,生命科学学院谭保才教授为通讯作者。
线粒体是半自主细胞器,具有自己的基因组。线粒体基因表达需要经过复杂的转录后加工过程,包括RNA C-U编辑、内含子剪接、5’和3’末端成熟和RNA稳定。RNA编辑广泛存在于植物细胞器(线粒体和叶绿体)中,是植物生长发育所必需的。然而,RNA编辑的机制还不清楚。现在已鉴定到多种RNA编辑因子,PLS-PPR类蛋白是重要的一种。PLS-型PPR蛋白根据末端结构域的不同又分为PPR-E、PPR-E+和PPR-DYW亚型。PPR基序可专一性地识别编辑位点,DYW结构域提供脱氨酶活性,但PPR-E+和PPR-E类蛋白不含有DYW结构域,最近的研究发现PPR-E+蛋白可以招募脱氨酶DYW2,然而PPR-E蛋白招募何种脱氨酶以及如何招募尚不清楚。
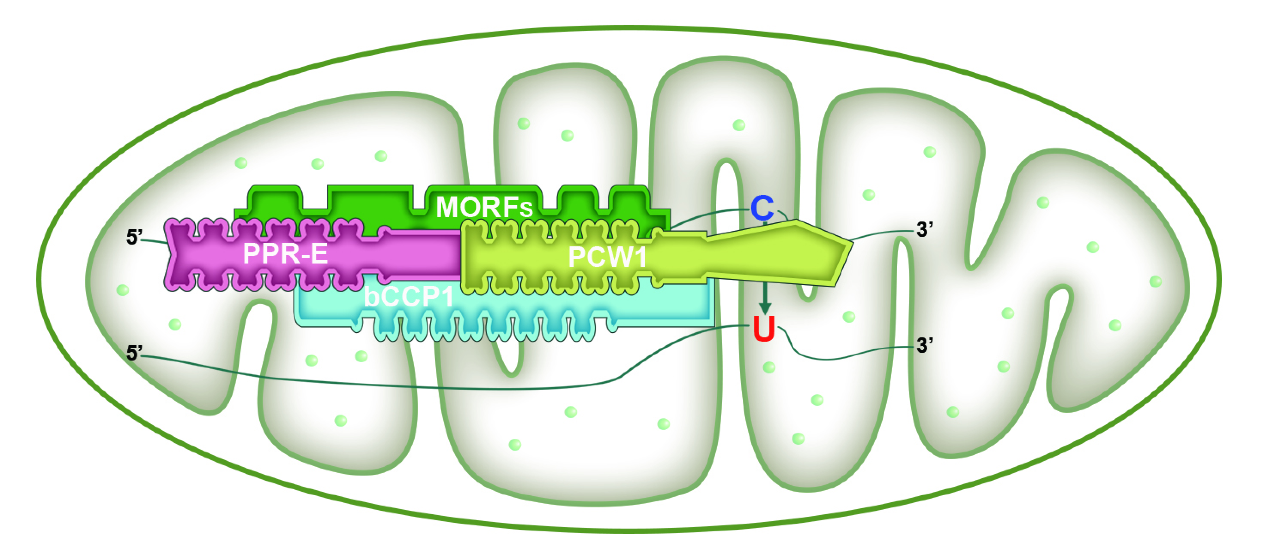
该研究以玉米籽粒发育突变体bCCP1为研究材料,该基因突变严重抑制了玉米的胚胎发生和胚乳发育。克隆发现bCCP1编码一个结构特殊的P-型PPR蛋白。除了具有PPR-基序以外,bCCP1还含有一个bZIP和Coiled-coil结构域。bCCP1既定位于线粒体,也定位也细胞核中。功能分析证明bCCP1参与了线粒体中66个位点的RNA编辑。蛋白质互作研究发现,bCCP1与PCW1紧密互作。PCW1为一个非典型的PPR-DYW蛋白,由5个PPR-基序、Coiled-coil和保守的DYW结构域组成,但不具有PPR-DYW类蛋白都有的E1和E2结构域。PCW1定位于线粒体。该研究利用CRISPR-Cas9技术构建了PCW1的功能缺失突变体PCW1-1和PCW1-2,证明该基因突变也严重抑制玉米胚胎发生和胚乳发育,导致籽粒败育。功能分析发现,PCW1参与线粒体102个位点的RNA编辑。意想不到的是,bCCP1参与编辑的66个位点都包含在PCW1负责的位点中。进一步分析显示,PCW1负责编辑的位点和PPR-E特异识别的位点高度重合,而与PPR-E+和PPR-DYW蛋白识别的位点不重合。因此,我们推测PCW1可能是PPR-E蛋白招募的脱氨酶。为了验证这个推测,该研究利用PPR-E蛋白EMP7为例子进行分析。EMP7、bCCP1和PCW1都负责线粒体ccmFN-1553位点的编辑。互作分析显示,虽然EMP7与PCW1可能不直接互作,但是bCCP1与EMP7和PCW1都紧密的互作。因此,bCCP1很可能连接和支持EMP7对PCW1蛋白的招募。MORF蛋白是通用的RNA编辑因子,参与了线粒体中大约80%编辑位点和叶绿体中几乎所有编辑位点的编辑。该研究发现bCCP1、PCW1和EMP7都与ZmMORF1/8直接相互作用,并且酵母三杂交实验显示ZmMORF8可以促进EMP7和PCW1的相互作用。根据以上的结果,该研究提出了一个PPR-E蛋白介导RNA编辑的模型,即PPR-E蛋白识别编辑位点,招募脱氨酶PCW1,特殊的PPR-P类蛋白bCCP1和RNA编辑因子MORF1/8通过与PPR-E互作协助招募,bCCP1同时与MORF1/8互作发挥作用。该研究解析了一个由PPR-E:bCCP1:MOEF1/8:PCW1四个蛋白构成的编辑体,该编辑体负责玉米线粒体66个位点的编辑,推测为单子叶特有。
该项研究得到了国家自然科学基金重点项目和青年项目的资助,谭保才教授团队长期从事玉米种子发育的分子调控机制研究,今年先后在PNAS (Yang et al., 2022)、Plant Cell (Wang et al., 2022)、Plant Cell (Liu et ., 2022)、New Phytologist (Zhao et al., 2022)和Plant Physiology (Cao et al., 2022)等国际著名期刊上发表研究论文。
论文链接:https://academic.oup.com/plcell/advance-article/doi/10.1093/plcell/koac298/6749580
