8月9日,刘利静团队与北大现代农业研究院张华伟团队及中科院遗传与发育所高彩霞团队合作在Genome Biology上联合发表了题为“Creating large‑scale genetic diversity in Arabidopsis via base editing‑mediated deep artificial evolution”的研究论文。该论文利用拟南芥生长周期短、种子量大、筛选容易等特点结合传代倍增突变体株系技术,开发了一种新的植物内源基因高通量深度定向进化方法。

基因的多样性是作物遗传育种的基础,随着全球人口的增加和对食物需求的增大,天然的突变形式已难以满足现代遗传育种的需求。近几年,随着基因编辑技术的发展,利用碱基编辑器进行的基因定向进化逐渐进入科学家的视野。相比于传统方法,定向进化可以更快地创造出生产需要的优势等位基因。但现有的人工定向进化技术一次可产生的突变体有限,导致单个基因编辑位点的进化潜能被严重低估。以胞嘧啶碱基编辑器(CBE)为例,该系统不仅可以造成C-to-T,还能够以较低的效率造成C-to-G和C-to-A的碱基替换。因此,当编辑窗口内存在多个C时,理论上可能存在数千乃至上万种潜在的突变形式。其中多数突变形式为低频突变,筛选出这些低频突变可能需要建立数十万甚至百万株系量级的突变体库。而现有的依赖于组培再生技术的植物基因人工定向进化系统难以获得如此大的突变体库。
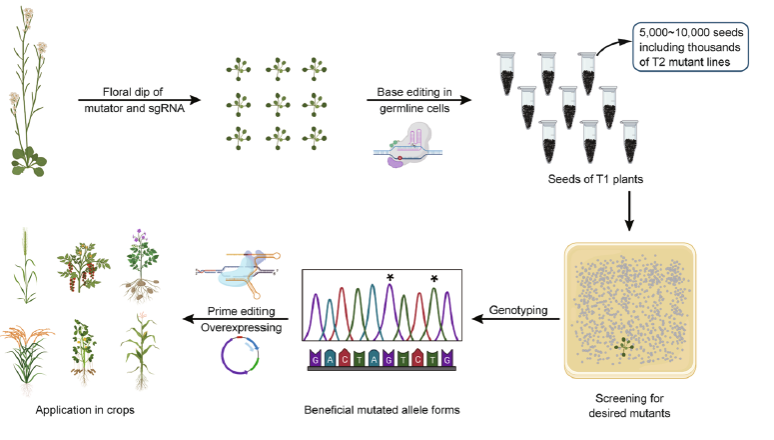
研究者使用卵母细胞特异性EC1启动子驱动的高效A3A-PBE编辑器,开发了拟南芥CBE编辑载体pHEE901-A3A。该载体将碱基编辑功能限制在有性繁殖过程中。测序发现大部分pHEE901-A3A产生的T1转基因植物未被编辑或者含有一个未被编辑的野生型等位。传代过程中,野生型等位可在生殖细胞中发生编辑,发生编辑的生殖细胞能够产生独立的后代突变体株系,传代过程的编辑效率为15%-77%。由于单株拟南芥能够产生超过10,000粒的种子,因此一棵T1植株的一次传代理论上可以创制数千个突变体株系。以此推算,生产一百万突变体株系仅需数百棵T1代拟南芥转基因植株。
伴随传代后突变体库规模的扩大,该定向进化方法有多个突出优势,包括:①编辑窗口显著拓宽;②罕见突变类型增多;③突变体类型更加丰富;④成功解决潜在终止密码子(突变后)定向进化的难题。
在此基础上,研究者对多个重要的除草剂靶标基因进行高通量深度定向进化。成功创制出耐草甘膦的EPSPS突变形式T178I/A179V/P182S和46种ALS除草剂抗性突变形式。并针对HPPD基因创制了迄今为止最大规模的单基因植物突变体库。通过筛选约300万T2代单株材料,研究者发现26种HPPD除草剂抗性突变形式。研究者进一步利用筛选出的ALS突变形式和引导编辑技术在水稻中创制了对除草剂广谱高抗的突变体,证实了拟南芥定向进化系统获得的突变形式在作物育种中的应用价值。
总之,该定向进化系统可以在植物基因单个位点创制大量突变体和丰富的突变形式,结合筛选过程可完成内源基因的高通量深度定向进化,获得功能显著改良的新突变形式并用于作物改良(如下图所示)。该系统在基因功能分析和作物种质资源创制中具有广阔的应用前景。
山东大学生命科学学院博士后王响、中科院遗传与发育生物学研究所博士生孙超、北京大学现代农业研究院博士后潘文波、研究助理杨红和程振涛为该论文的共同第一作者。北京大学现代农业研究院张华伟研究员、山东大学刘利静教授和中科院遗传与发育生物学研究所高彩霞研究员为该论文的共同通讯作者。山东大学生命科学学院已毕业硕士生颜飞、马国婧,北京大学现代农业研究院副研究员尚云,中科院遗传与发育生物学研究所副研究员张瑞参与了该工作。该研究得到了泰山青年学者、山东省杰出青年基金和国家重点研发计划的资助。
原文链接:
https://genomebiology.biomedcentral.com/articles/10.1186/s13059-024-03358-9
